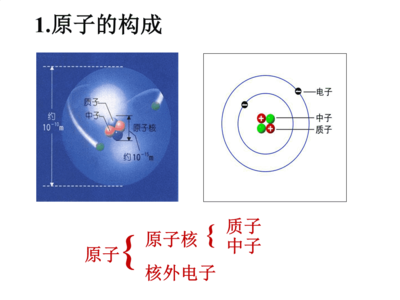
原子核外电子的排布并非杂乱无章,而是遵循着一系列基本的物理规律。理解这些规律是掌握原子结构与元素性质关系的关键。
一、电子排布遵循的基本原则
- 能量最低原理:电子总是优先占据能量最低的轨道,以使整个原子体系处于能量最低、最稳定的状态。电子填充轨道的顺序遵循构造原理,即从1s轨道开始,按能级组由低到高依次填充。
- 泡利不相容原理:在同一个原子中,不可能存在运动状态完全相同的两个电子。换言之,每一个原子轨道最多只能容纳两个自旋方向相反的电子。
- 洪特规则:当电子在能量相同的轨道(即简并轨道,如三个p轨道、五个d轨道)上排布时,总是优先以自旋方向相同的方式,单独占据不同的轨道。这种排布方式使原子的能量最低、最稳定。洪特规则的特例是,对于同一电子亚层,当电子排布处于全充满、半充满或全空状态时,原子体系比较稳定。
二、核外电子排布的表示方法
- 原子结构示意图:用圆圈表示原子核及核电荷数,用弧线表示电子层,弧线上的数字表示该层上的电子数。这是一种直观但不够精确的表示方法。
- 电子排布式:这是最常用且精确的表示方法。它按能级顺序写出各亚层符号,并在其右上角用数字标出该亚层上的电子数。例如,钠原子(Na,原子序数11)的电子排布式为:1s²2s²2p⁶3s¹。对于部分原子,为简化书写,常用其前一周期的稀有气体元素符号加方括号表示内层电子构型,如钠也可表示为[Ne]3s¹。
- 轨道表示式(又称电子排布图):用小方格(或圆圈)代表原子轨道,用箭头(↑和↓)表示电子的自旋状态。它能更直观地体现洪特规则和泡利原理。
三、电子排布与元素周期律
核外电子排布的周期性变化是元素性质(如原子半径、电离能、电负性等)呈现周期性变化的根本原因。主族元素的价电子排布(即最外层电子排布)决定了其主要的化学性质。例如,碱金属元素的最外层都是ns¹结构,易于失去一个电子形成+1价阳离子,表现出强烈的金属性。
掌握原子核外电子排布的规律,不仅能帮助我们书写任意原子的电子构型,更是理解元素在周期表中的位置、预测元素及其化合物物理化学性质的理论基石。